News
Neuer Verknüpfungstyp für Ubiquitin entdeckt
Dezember 2016. Ein Forscherteam unter Leitung von IBC2-Direktor und CEF-Mitglied Ivan Dikic hat einen neuartigen Mechanismus zur Ubiquitinierung aufgeklärt, der zahlreiche biologische Prozesse beeinflussen könnte. Ihr Bericht erscheint in der aktuellen Ausgabe der Fachzeitschrift Cell.
Im April dieses Jahres beschrieben Kollegen aus den USA erstmals eine Form der Ubiquitinierung, an der nur ein einziges Enzym (SdeA) aus Legionellen beteiligt ist. Die Frankfurter Forscher haben nun gemeinsam mit der Gruppe von Ivan Matic (Max-Planck-Institut für Biologie des Alterns, Köln) die zugrundeliegenden chemischen Prozesse im Detail analysiert und stießen auf einen bislang unbekannten Bindungstyp zwischen Ubiquitin und Zielprotein. Im Gegensatz zur konventionellen Ubiquitinierung ist diese neue Reaktion abhängig von NAD, verläuft über ein ADP-Ribose-Zwischenprodukt und resultiert in einer Phosphodiester-Bindung zwischen Ubiqitin und Serinresten von Zielproteinen.
Allein diese Ergebnisse sind bahnbrechend für die Fachwelt. Umso überraschter war das Team, als es entdeckte, dass das Legionellen-Enzym nicht nur zelluläre Proteine ubiquitiniert, sondern gleichzeitig alle verbleibenden Ubiquitin-Moleküle mit einer Phosphoribosyl-Gruppe chemisch modifiziert. Phosphoribosyliertes Ubiquitin hemmt das klassische Ubiquitin-System, so dass wichtige zelluläre Prozesse wie z.B. der proteasomale Abbau von Proteinen, die Mitophagie und die proinflammatorische Signaltransduktion beeinträchtigt werden. Dadurch lassen sich unter anderem die pathogenen Effekte einer Legionellen-Infektion bei immungeschwächten Patienten erklären, bei denen es trotz Antibiotikatherapie zu schweren Gewebeschäden in der Lunge kommt. Durch die Erkenntnisse von Dikic und seinen Kollegen könnten sich nun neue Strategien für die Entwicklung antibakterieller Agenzien ergeben, die komplementär zu konventionellen Antibiotika wirken und die zellulären Schäden durch bakterielle Enzyme begrenzen.
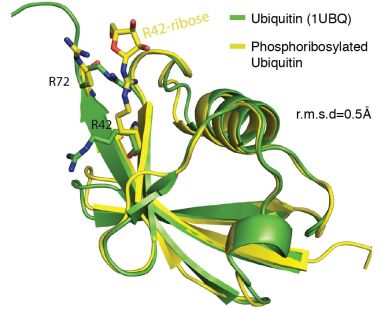
Abbildung: Übereinander gelegte Kristallstrukturen von Ubiquitin (grün) und Ubiquitin, welches durch das Legionellenenzym modifiziert wurde (gelb). Modifiziertes Ubiquitin enthält eine zusätzliche Phosphoribosyl-Gruppe an Aminosäure-Position 42 (Quelle: Cell, Dezember 2016).
Publikation:
Bhogaraju S, Kalayil S, Liu Y, Bonn F, Colby T, Matic I, Dikic I. 2016. Phosphoribosylation of ubiquitin promotes serine ubiquitination and impairs conventional ubiquitination. Cell 167(6). DOI 10.1016/j.cell.2016.11.019. Link
Informationen:
Kerstin Koch, Institut für Biochemie II, Universitätsklinikum der Goethe-Universität Frankfurt am Main, Tel.69 6301 84250, koch@biochem2.de
Link to Cell paper
Link to German press release
Folgen auf twitter oder facebook
Exzellenzcluster Makromolekulare Komplexe, Frankfurt am Main

