Forschungsbereich E: Methoden zur Analytik makromolekularer Komplexe
Um Leben zu verstehen, ist es erforderlich, die Änderungen makromolekularer Komplexe in drei Dimensionen als Funktion der Zeit zu verfolgen. CEF hat die technologische Infrastruktur in Frankfurt durch den Kauf neuer Geräte verbessert und zusätzlich die verfügbaren Methoden auf höchstem Niveau weiter entwickelt inkl. NMR-Spektroskopie, Cryo-Elektronenmikroskopie, Kristallographie, Lichtspektroskopie und Massenspektrometrie.
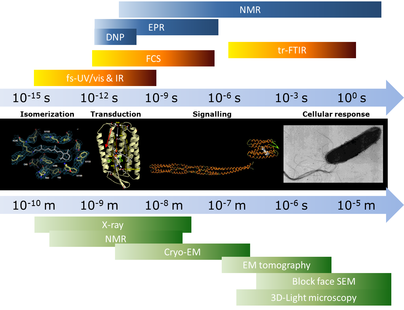
Dieses Methodenarsenal erlaubte es, einzelne Moleküle, sowohl isoliert als auch in Membranen und ganzen Zellen, mit der besten räumlichen Auflösung von weniger als einem Zehntel Nanometer und ultraschnell, in weniger als einer Billiardstel Sekunde, zu untersuchen. Damit erzielten CEF-Mitglieder ein lückenloses Bild einer Vielzahl makromolekularer Komplexe. Dieser Zweig der Erforschung makromolekularer Komplexe, die Strukturbiologie, ist somit unverzichtbar zum Verständnis zellulärer Prozesse.
Auf der Basis der ermittelten Strukturen konnten funktionale zellbiologische Experimente entwickelt werden, die im Vordergrund der anderen Schwerpunkte des CEF standen. Präzision, Auflösung und Zeitraum der Messungen hängen von den biologischen Systemen und den Fragestellungen ab. Geeignete Methoden, um die Änderungen der Komplexe zu erfassen, sind ort- und zeitaufgelöste spektrale Verfahren. Jede dieser spektroskopischen Methoden hat ihre eigenen Herausforderungen.
Mit der Elektronenmikroskopie lässt sich die Struktur von größeren Komplexen bis hin zu Organellen präzise bestimmen. Auch hier werden wesentliche methodische Durchbrüche zur Verbesserung der Phasenkontraste der elektronenmikroskopischen Bilder in Frankfurt vorangetrieben. Die bereits in Frankfurt etablierten Gruppen wurden durch Berufungen und Nachwuchsgruppen verstärkt. Das Frankfurt Center for Electron Microscopy wurde durch CEF gegründet und im Buchmann Institute for Molecular Life Sciences (BMLS) auf dem Riedberg Campus etabliert.
Kristallstrukturanalyse wird eingesetzt zur Strukturbestimmung von Proteinen in Membranen sowie von Protein-RNA-Komplexen. Solche makromolekularen Komplexe enthalten Hunderttausende von Atomen und sind häufig nicht stabil, sondern bilden sich nur vorübergehend. Mehrere Gruppen arbeiteten am CEF mit der Methode der Kristallstrukturanalyse. Durchbrüche konnten insbesondere bei Membranproteinen der Atmungskette und bei Komplexen des Ribosoms, an die Antibiotika gebunden wurden, erzielt werden.
Die Struktur und Funktion wichtiger makromolekularer Komplexe wurden von CEF auf atomarer Auflösung bestimmt, so z.B. von Komplex I und der ATP-Synthase der mitochondrialen Atmungskette sowie des eukaryotischen Antigenpeptid-Transporter TAP.
Die NMR-Spektroskopie ist insbesondere für die Untersuchung der Struktur und Dynamik von Biomakromolekülen entscheidend. Eine der wesentlichen Limitationen ist die beschränkte Empfindlichkeit der Methode. Complementary to electron and light microscopy, CEF invested into new developments in spectroscopy. Frankfurt is almost unique in the range of spectroscopy methods available for biological applications plus the deep level of knowledge associated with it. Great progress has been made in developing biomolecular NMR and EPR. The members of the Center for Biomolecular Magnetic Resonance (BMRZ) joined forces to improve the sensitivity of liquid- and solid-state NMR by a spectrometer featuring dynamic nuclear polarization (DNP). PELDOR-EPR wurde zu einer Auflösung entwickelt, die sogar Messungen in der Zelle ermöglicht.
Es gibt verschiedene Methoden der Massenspektroskopie (MS), also die exakte Vermessung der Masse makromolekularer Komplexe. Wesentliche Impulse für die MALDI- und die LILBID-Spektroskopie kommen aus Frankfurt. Die LILBID-Spektroskopie ist eine erst kürzlich in Frankfurt entwickelte Methode, die es ermöglicht, makromolekulare Komplexe während der Messung intakt zu lassen. Dadurch erhält man völlig neuartige Informationen über die Zusammensetzung der Komplexe, was bis bisher mit MS nicht möglich war.
Eine ideale Fluoreszenzmikroskopie liefert dreidimensionale Bildstapel mit exzellenter Empfindlichkeit, einer ausreichenden Probendurchdringung und einer isotropen Auflösung. Sie ist insbesondere für optisch dichte Proben geeignet, die eine heterogene Struktur aufweisen. Die moderne Lichtmikroskopie zeichnet sich vor allem dadurch aus, dass sie komplexe Prozesse in drei Dimensionen als Funktion der Zeit, also dynamisch, verfolgen kann. Ernst Stelzers Lichtscheibenmikroskopie wurde zur internationalen Methode des Jahres gewählt und steht Anwendern in Frankfurt in dem von ihm gegründeten Frankfurt Center for Advanced Light Microscopy im BMLS zur Verfügung.
Die sinnvolle Anwendbarkeit von Modellorganismen zur Untersuchung bestimmter Fragestellungen hängt von mehreren Faktoren ab, wie zum Beispiel Generationszeit, Verfügbarkeit einer vollständigen Genomsequenz und einfache Erzeugung von genomischen Mutanten. Im CEF wurde vor allem am Fadenwurm Caenorhabditis elegans, den Hefen Saccharomyces cerevisiae und Yarrowia lipolytica, dem Hyphenpilz Podospora anserina sowie die Maus als eukaryontische Modellorganismen geforscht.
Die Entwicklung quantitativer Modelle, die für molekulare, zelluläre und multizelluläre Prozesse skalierbar sind, ist weiterhin ein fundamentales Ziel der modernen mathematisch-physikalisch orientierten Lebenswissenschaften.
Zeit- und Längenskalen der spektroskopischen und mikroskopischen Techniken des CEF zur Untersuchung der Struktur und Dynamik von makromolekularen Komplexen