News Archive
Architektur des größten Proteinkomplexes in der Atmungskette aufgeklärt
Nanomaschinen in den Kraftwerken der Zelle
2. Juli 2010
Selbst wenn wir nichts tun, produzieren die Mitochondrien in unseren Zellen fortwährend Energie. Bei einem ruhenden Mensch liefern sie eine Leistung von etwa 100 Watt. Bereitgestellt wird diese Energie in Form von Adenosintriphosphat, kurz ATP, beispielsweise im Muskelgewebe, damit wir bei Gefahr blitzschnell reagieren können. Seit vielen Jahren untersuchen Frankfurter Forscher den komplexen Mechanismus, mit dem ATP in der Zellmembran der Mitochondrien gewonnen wird. Eine Kette von fünf molekularen Maschinen, sogenannten Atmungsketten-Komplexen, ist daran beteiligt. Die Strukturen der drei mittleren Komplexe wurden bereits von Wissenschaftlern des Frankfurter Exzellenzclusters „Makromolekulare Komplexe“ aufgeklärt. Nach 10jähriger Forschungsarbeit ist es nun auch die röntgenkristallographische Strukturanalyse des riesigen ersten Proteinkomplexes aus mehr als 40 verschiedenen Proteinen gelungen. Die Ergebnisse erscheinen in der aktuellen Online-Ausgabe der Fachzeitschrift „Science“.
„Ein detailliertes Verständnis der Funktion von Komplex I ist von besonderem medizinischem Interesse, da Fehlfunktionen mit einer Reihe von neurodegenerativen Erkrankungen wie Morbus Parkinson oder Morbus Alzheimer, aber auch dem biologischen Altern insgesamt, in Verbindung gebracht werden“, so Prof. Ulrich Brandt, Professor für Molekulare Bioenergetik und Mitglied im Exzellenzcluster „Makromolekulare Komplexe“. Seine Arbeitsgruppe klärte die Architektur des Komplex I in Kooperation mit Carola Hunte auf, vormals Adjunct Investigator des Exzellenzclusters und jetzt Professorin an der Universität Freiburg.
Die Herstellung von ATP in den Mitochondrien durchläuft deshalb so viele Schritte, weil die zugrunde liegende Umsetzung einer Knallgasreaktion entspricht. Lässt man im Labor Wasserstoffgas und Sauerstoff miteinander reagieren, verpufft die in den Ausgangsstoffen enthaltene Energie explosionsartig in Form von Wärme. Bei der biologischen Oxidation durch die membrangebundenen Proteinkomplexe der Atmungskette wird die Energie dagegen kontrolliert in kleinen Paketen freigesetzt und wie bei einer Brennstoffzelle in ein elektrisches Membranpotential umgewandelt, das letztendlich für die Synthese von ATP genutzt werden kann. Zusammengerechnet bilden die Oberflächen der Mitochondrien im menschlichen Körper eine Fläche von 14.000 Quadratmetern. Dort werden täglich etwa 65 Kilogramm ATP produziert.
Das jetzt vorgestellte Strukturmodell gibt wichtige und unerwartete Hinweise auf die Funktionsweise von Komplex I. Eine aus keinem anderen Protein bekannte Form eines molekularen „Transmissionsgestänges“ scheint demnach für den Energietransfer innerhalb des Proteinkomplexes durch mechanische Kopplung im Nanomaßstab verantwortlich zu sein. Übertragen auf die Welt der Technik ließe sich dies als eine Kraftübertragung durch eine Art Kuppelstange beschreiben wie sie etwa die Räder einer Dampflok verbindet. Dieser neue nanomechanische Ansatz soll nun durch ergänzende funktionelle Studien und eine verfeinerte strukturelle Analyse weiter untersucht werden.
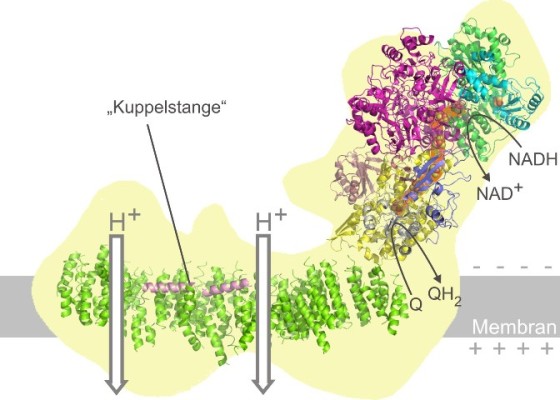
Abbildung: Das Strukturmodell des mitochondrialen Komplex I erlaubt Rückschlüsse auf seine Funktion: Im oberen rechten Teil wird gebundener Wasserstoff von NADH auf Coenzym Q übertragen. Dabei fließen Elektronen über eine Serie sogenannter Eisen-Schwefel Zentren (orange unterlegt). Die Wasserstoffübetragung treibt zwei Protonen Pumpen im Membranteil des riesigen Enzymkomplexes an. Die Pumpmodule sind über eine molekulare "Kuppelstange" verbunden. Durch diesen Ladungstransport entstehtein elektrisches Potential über die Membran, dass vom Komplex V der Atmungskette zur ATP-Synthese genutzt wird (nicht gezeigt).
Weitere Informationen: Prof. Ulrich Brandt, Molekulare Bioenergetik, Exzellenzcluster Makromolekulare Komplexe, Campus Niederrad, Frankfurt am Main, Tel. +49 (0)69 6301-6925; brandt@zbc.kgu.de.
Veröffentlichung: Carola Hunte, Volker Zickermann & Ulrich Brandt. 2010. Functional modules and structural basis of conformational coupling in mitochondrial complex I. Science. Veröffentlicht Online 1. Juli 2010, DOI: 10.1126/science.1191046. Mehr...

