News Archive
Struktur von amyloid-formenden, Krankheits-assoziierten Lysozym-Mutationen aufgeklärt
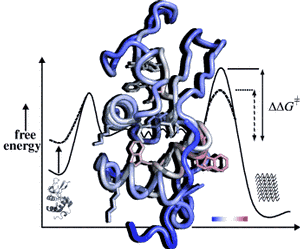
18. Mai 2011.Fehlerhafte Proteinfaltung ist die Ursache zahlreicher Erkrankungen, ein prominentes Beispiel ist die Alzheimer Erkrankung. Oft sind vererbte Punktmutationen mit spezifischen Formen der jeweiligen Erkrankungen verknüpft. Punktmutationen im humanen Protein Lysozym führen beispielsweise zur Ablagerung von amyloiden Plaques im kg-Maßstab in verschiedenen Organen. Der zugrundeliegende strukturelle Code, der über den Ausbruch der assoziierten Erkrankungen entscheidet, ist bislang nicht geklärt. Wie kürzlich in ‚Angewandte Chemie‘ berichtet, konnte die Gruppe von CEF-Sprecher Prof. Dr. Harald Schwalbe durch NMR-spektroskopische Analyse mit atomarer Auflösung zeigen, wie eine Punktmutation in dem Protein Lysozym die Struktur und die Dynamik ungefalteter und partiell gefalteter Lysozym-Moleküle moduliert. Der Grad der verbleibenden Proteinstruktur korreliert mit der Fähigkeit des Proteins, amyloide Fasern zu bilden. Die Verteilung der freien Energie zwischen den verschiedenen Zuständen der partiell aufgeschmolzenen Proteinmoleküle wird demnach durch die Punktmutationen beeinflusst.
Link zur vollen Publikation in Angewandte Chemie
Publikation
Sziegat F, Wirmer-Bartoschek J, Schwalbe H (2011) Characteristics of human lysozyme and its disease-related mutants in their unfolded states. Angew Chem Int Edit:in press

