News Archive
Futtersuche: bei Mensch und Wurm ähnlich reguliert?
November 2018. Wie motiviert uns unser Nervensystem, vom Sofa aufzustehen und zum Kühlschrank oder sogar zum Supermarkt zu gehen, um Essen zu holen? Das Finden von Nahrung und das Verweilen an einer Nahrungsquelle sind entscheidende Überlebensstrategien im Tierreich. Wie kommunizieren Nervenzellen miteinander, um so komplexe Verhaltensweisen zu erreichen, und wie entwickelte sich dies im Laufe der Evolution? Ein Forscherteam um Alexander Gottschalk von der Goethe-Universität Frankfurt hat untersucht, wie externe Futter-Signale bei einem Wurm auf molekularer, zellulärer und neuronaler Schaltkreis-Ebene in Verhalten verwandelt werden. Ihre Versuche mit diesem Modellorganismus liefern wichtige Hinweise für die evolutionäre Entwicklung von (Nahrungs-) motivierten Verhalten bei höheren Tieren.
Ein wichtiges Ziel der Neurowissenschaften ist es zu verstehen, wie Nervenzellen im Gehirn miteinander kommunizieren, um Verhalten zu erzeugen. Da das Gehirn von Menschen und anderen Säugetieren sehr komplex ist und aus Milliarden von Neuronen besteht, verwenden Wissenschaftler kleine einfacher aufgebaute Tiere als Versuchsmodelle, um die Grundprinzipien zu entschlüsseln. Der Fadenwurm C. elegans ist ein besonders gutes Tiermodell für diese Art der Forschung. Er besitzt nur 302 Nervenzellen und das Netzwerk von Verbindungen zwischen seinen Nervenzellen wurde präzise kartiert. So können Forscher im Detail untersuchen, wie diese Nervenzellen miteinander kommunizieren, um bestimmte Verhaltensweisen zu erreichen.
Nervenzellen "sprechen" miteinander, indem sie chemische Botschaften austauschen. Verhaltensänderungen, Verhaltenszustände und Strategien für die Fortbewegung benötigen die Modulation neuronaler Schaltkreise durch verschiedene chemische Botenstoffe. Beim Finden von Nahrung und dem Verweilen an einer Nahrungsquelle sind die chemische Botenstoffe Dopamin, Serotonin sowie mehrere Neuropeptide von besonderer Bedeutung.
Bei kleinen Tieren wie C. elegans übernehmen einzelne Nervenzellen als Teil von Sinnes-, Signal- und Regulierungssystemen eine Vielzahl von Aufgaben, damit Körperhaltung, Bewegungen und komplexere Verhaltensweisen koordiniert werden können. Alexander Gottschalk und sein Team konzentrierten sich in ihrer Studie auf einen neuronalen Schaltkreis an dessen ‚Spitze‘ ein Paar sensorischer Nervenzellen steht, die das Vorhandensein von Nahrung erkennen und den Neuromodulator Dopamin freisetzen.
Dieses Dopamin-Signal wirkt sich auf zwei Arten von nachgeschalteten Neuronen aus, die als DVA und AVK bezeichnet werden. Das Forscherteam entdeckte, dass diese beiden Interneuronen auf entgegengesetzte Weise von Dopamin beeinflusst werden: DVA und AVK vermitteln die Information über das Vorhandensein oder Fehlen von Nahrung durch unterschiedliche Neuropeptide weiter an Motoneuronen. DVA fördert dadurch ein Verweilen und ein lokales Suchverhalten, während AVK eine Futtersuche über längere Distanzen fördert. Dies zeigt, dass Nahrungssignale über Dopamin an peptiderge Neuronen weitergeleitet werden, die den Bewegungsapparat auf verschiedene Fortbewegungsstrategien umstellen.
Das DVA-Neuron beeinflusst die Fortbewegung, indem es das Neuropeptid NLP-12 als Signal an Motoneuronen weiterleitet. Säugetiere haben ein äquivalentes Neuropeptid, das Cholecystokinin (CCK), welches ebenfalls motiviertes Verhalten und Bewegungskontrolle reguliert. Seine Freisetzung wird auch durch Dopamin-Signale reguliert, z.B. bei belohnungsabhängigem Verhalten. Dies zeigt, dass im Laufe der Evolution die Bedeutung von Dopamin und Cholecystokinin/NLP-12 als Neuromodulatoren erhalten blieb. Sie beeinflussen motiviertes Verhalten bei der Suche nach Nahrung sowie bei anderen Aktivitäten, wenn durch bestimmtes Verhalten positive Empfindungen herbeigeführt werden können.
Das Neuron AVK, welches antagonistisch zum DVA-Neuron wirkt, setzt bei fehlender Nahrung das Neuropeptid FLP-1 frei. Dieses hemmt gewisse Motoneuronen, um die Körperhaltung und -geschwindigkeit zu regulieren. FLP-1 wirkt im Wurm als Gegenspieler zu NLP-12/Cholecystokininin. Obwohl FLP-1 wahrscheinlich auf wirbellose Tiere beschränkt ist, finden sich ähnliche "RF-Amid"-Neuropeptide bei Säugetieren, wo sie ebenfalls die Nahrungsaufnahme kontrollieren.
Ein analoges Ausbalancieren der Cholecystokinin-Signale kommt daher womöglich auch bei Säugetieren vor. Die in dieser Studie identifizierten Neuronentypen können daher wichtige Hinweise für die Suche nach ähnlichen Zelltypen bei Säugetieren liefern, wo Myriaden von Zellen ähnliche Mechanismen der Bewegungskontrolle vermitteln.
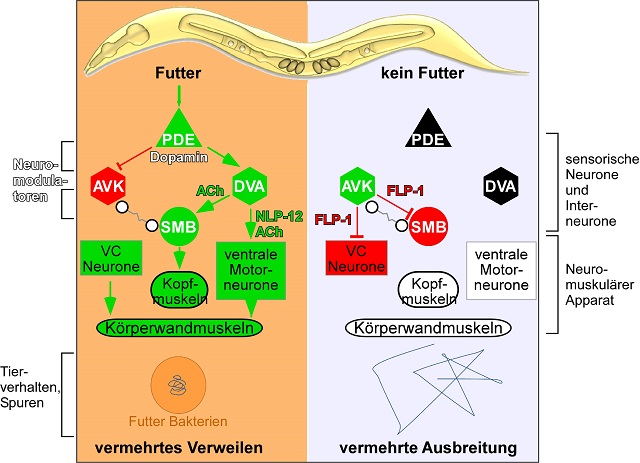
Bildunterschrift: In dieser Studie über das Futtersuchverhalten des Fadenwurms C. elegans wurde der zugrunde liegende Nervenschaltkreis untersucht. Dopamin-produzierende Nervenzellen signalisieren das Vorhandensein von Futter an zwischengeschaltete Nervenzellen. Diese Interneuronen setzen Neuropeptide frei, die wiederum spezifische Reaktionen bei Motorneuronen hervorrufen, wodurch die Fortbewegung des Wurms reguliert wird. Nervenzellen sind nach ihrer Art als Dreiecke (sensorisch), Sechsecke (Interneuronen) oder Kreise (Motorneuronen) dargestellt. Zu den Neuromodulatoren gehören das Dopamin sowie die Neuropeptide NLP-12 (ähnlich zum Cholecystokinin der Wirbeltiere) und FLP-1 (ein RF-Amid-Neuropeptid; diese sind nur in abgewandelter Form beim Säugetier zu finden). Dopamin wird von den Futter-wahrnehmenden PDE-Nervenzellen freigesetzt, und blockiert das AVK-Neuron, bzw. aktiviert das DVA-Neuron. AVK und DVA setzen FLP-1 und NLP-12 als inhibierend bzw. aktivierend wirkende Neuropeptide frei. Bestimmte Nervenzellen im neuromuskulären Apparat haben Rezeptoren für das eine oder andere Neuropeptid und werden dadurch aktiviert oder inhibiert (grün oder rot gekennzeichnet). Schwarz/weiß: Neuronen oder Muskelgruppen die nicht moduliert werden, weil Futter und/oder der entsprechende Neuromodulator nicht vorhanden sind. Unten angedeutet sind die Spuren, die ein einzelner Wurm auf einer Kulturschale mit oder ohne Futterbakterien hinterlässt. Abbildung: A. Bergs, A. Gottschalk.
Kontakt:
Alexander Gottschalk, Buchmann Institut für Molekulare Lebenswissenschaften und Institut für Biophysikalische Chemie, Campus Riedberg, Goethe-Universität, Frankfurt am Main, a.gottschalk@em.uni-frankfurt.de
Publikation:
Alexandra Oranth, Christian Schultheis, Oleg Tolstenkov, Karen Erbguth, Jatin Nagpal, David Hain, Martin Brauner, Sebastian Wabnig, Wagner Steuer Costa, Rebecca D. McWhirter, Sven Zels, Sierra Palumbos, David M. Miller, III, Isabel Beets, Alexander Gottschalk. 2018. Food sensation modulates locomotion by dopamine and neuropeptide signaling in a distributed neuronal network. Neuron, published online 1 November 2018. http://dx.doi.org/10.1016/j.neuron.2018.10.024

